Introducción a la Materia y sus Mezclas
La materia se presenta en diversas formas, desde sustancias puras (elementos y compuestos) hasta mezclas. Estas últimas pueden ser homogéneas o heterogéneas. Para comprender y trabajar con la materia, es fundamental conocer los métodos físicos de separación que permiten aislar sus componentes.
Conceptos Fundamentales en Química
- Disolvente: Sustancia que disuelve otra.
- Soluto: Sustancia que se disuelve en un disolvente.
- Disolución: Mezcla homogénea de soluto y disolvente.
- Tamizado: Separación de partículas por tamaño usando un tamiz.
- Termómetro: Instrumento que mide la temperatura.
- Centrífuga: Aparato que separa sustancias por densidad usando rotación rápida.
- Elemento: Sustancia pura que no se puede descomponer químicamente.
- Compuesto: Sustancia formada por dos o más elementos químicamente unidos.
- Cromatógrafo: Aparato que separa componentes de una mezcla.
- Destilación: Purificación de líquidos por vaporización.
- Tamiz: Malla con orificios que separa partículas por tamaño.
- Filtro: Material poroso que separa sólidos de líquidos o gases.
Métodos Físicos de Separación de Mezclas
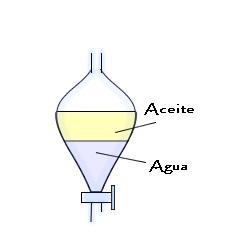
1. Decantación
Definición general:
Método físico para separar líquidos inmiscibles o un sólido de un líquido, aprovechando la diferencia de densidades.
¿Qué separa?:
Líquidos inmiscibles (líquidos que no se mezclan, como agua y aceite) o un sólido de un líquido, aprovechando la diferencia de densidades.
Características:
- Simple, rápido y económico.
- No requiere equipo sofisticado.
- Ineficaz para separar líquidos miscibles o sólidos muy finos dispersos en un líquido.
Principio básico:
Se basa en la diferencia de densidades. El líquido o sólido más denso se deposita en el fondo, permitiendo separar la fase superior.
Explicación:
La gravedad permite que las fases se separen naturalmente, facilitando su extracción por separado.
Ejemplos:
- Separar aceite de agua.
- Separar arena del agua.
2. Filtración
Definición general:
Método para separar sólidos de líquidos o gases utilizando un medio poroso.
¿Qué separa?:
Sólidos insolubles de un líquido o gas.
Principio básico:
El filtro retiene las partículas sólidas, permitiendo que el líquido o gas pase a través de él. El tamaño de poro del filtro determina el tamaño de las partículas retenidas.
Características:
- Simple y efectivo para separar sólidos de diferentes tamaños.
- Aplicable a grandes volúmenes.
- El tipo de filtro influye en la eficiencia.
Ejemplos:
- Filtrar café.
- Purificar agua.
- Separar arena del agua.

3. Evaporación
Definición general:
Método para separar un sólido disuelto en un líquido mediante la eliminación del líquido por vaporización.
¿Qué separa?:
Un sólido disuelto en un líquido.
Principio básico:
Se calienta la disolución hasta que el líquido se evapora, dejando el sólido como residuo.
Características:
- Simple y efectivo para separar sólidos no volátiles de líquidos.
- Puede ser lento y requerir altas temperaturas.
- Puede perder parte del sólido si este es volátil.
Explicación:
La diferencia en los puntos de ebullición del sólido y el líquido permite la separación.
Ejemplos:
- Obtener sal del agua de mar.
- Secar ropa al sol.
4. Cristalización
Definición general:
Método para purificar sólidos disueltos en un líquido, mediante la formación de cristales.
¿Qué separa?:
Un sólido disuelto en un líquido, purificándolo.
Principio básico:
Se hace que la disolución sobresaturada (con más soluto disuelto de lo que puede soportar) se enfríe lentamente, permitiendo que el soluto forme cristales puros.
Características:
- Permite obtener sólidos de alta pureza.
- Puede ser un proceso lento y delicado.
Explicación:
La formación de cristales se basa en la solubilidad del sólido en el solvente a diferentes temperaturas.
Ejemplos:
- Obtención de azúcar.
- Formación de cristales de sal.


5. Destilación
Definición general:
Método para separar líquidos miscibles con diferentes puntos de ebullición.
¿Qué separa?:
Líquidos miscibles.
Principio básico:
Se calienta la mezcla hasta que el líquido con el punto de ebullición más bajo hierve, se vaporiza y luego se condensa en otro recipiente.
Características:
- Eficaz para separar líquidos con puntos de ebullición significativamente diferentes.
- Requiere equipo específico (matraz, refrigerante).
Explicación:
Se aprovecha la diferencia en los puntos de ebullición para separar los componentes de una mezcla líquida.
Ejemplos:
- Obtención de alcohol etílico.
- Purificación de agua.
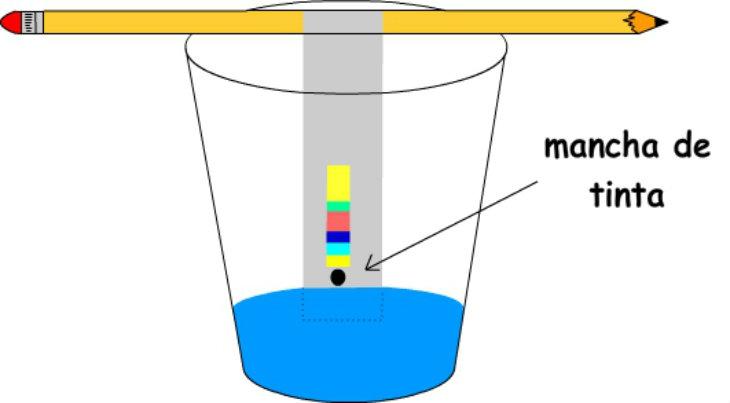
6. Cromatografía
Definición general:
Método para separar los componentes de una mezcla basándose en su diferente afinidad con una fase estacionaria y una fase móvil.
¿Qué separa?:
Componentes de una mezcla compleja (líquidos o gases).
Principio básico:
La mezcla se hace pasar a través de una fase estacionaria (sólida o líquida) mientras una fase móvil (líquida o gaseosa) la arrastra. Los componentes con mayor afinidad por la fase móvil se mueven más rápido.
Características:
- Muy versátil, permite separar componentes con propiedades muy similares.
- Puede ser compleja y requerir equipo especializado.
Explicación:
Se basa en las diferentes interacciones entre los componentes de la mezcla y las fases estacionaria y móvil.
Ejemplos:
- Separación de pigmentos de una tinta.
- Análisis de sangre.

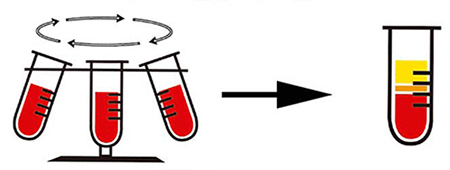
7. Centrifugación
Definición general:
Método para separar sólidos de líquidos o líquidos de diferente densidad utilizando la fuerza centrífuga.
¿Qué separa?:
Sólidos de líquidos (especialmente suspensiones) o líquidos de diferente densidad.
Principio básico:
La rotación rápida genera una fuerza centrífuga que separa las partículas según su densidad. Las partículas más densas se depositan en el fondo.
Características:
- Eficaz para separar partículas muy finas que no se sedimentan fácilmente por gravedad.
- Requiere equipo específico (centrífuga).
Explicación:
La fuerza centrífuga imita la gravedad a una escala mucho mayor, acelerando la sedimentación.
Ejemplos:
- Separar componentes de la sangre.
- Separar crema de leche.
8. Imantación
Definición general:
Método para separar materiales magnéticos de no magnéticos.
¿Qué separa?:
Materiales magnéticos de no magnéticos.
Principio básico:
Se utiliza un imán para atraer los materiales magnéticos, separándolos de los no magnéticos.
Características:
- Simple, rápido y económico.
- Solo aplicable a materiales con propiedades magnéticas.
Explicación:
La atracción magnética separa los materiales según su susceptibilidad magnética.
Ejemplos:
- Separar limaduras de hierro de arena.
- Reciclar metales.
9. Tamización
Definición general:
Método para separar sólidos de diferentes tamaños utilizando un tamiz.
¿Qué separa?:
Sólidos de diferentes tamaños.
Principio básico:
El tamiz tiene orificios de un tamaño específico, reteniendo las partículas más grandes y dejando pasar las más pequeñas.
Características:
- Simple y efectivo para separar sólidos con diferencias de tamaño significativas.
Explicación:
Se aprovecha la diferencia de tamaño de las partículas para separarlas.
Ejemplos:
- Separar arena de grava.
- Clasificar granos de café.
10. Flotación
Definición general:
Método de separación que utiliza la diferencia de densidad entre los componentes de una mezcla para separarlos mediante la adición de un agente espumante.
¿Qué separa?:
Sólidos de diferentes densidades, generalmente minerales de ganga (materiales de desecho). También puede usarse para separar líquidos inmiscibles con diferentes densidades.
Principio Básico:
Se basa en la adhesión selectiva de las partículas sólidas a burbujas de aire. Las partículas de menor densidad se adhieren a las burbujas y flotan a la superficie, mientras que las partículas más densas permanecen en la pulpa.
Características:
- Eficiente para separar sólidos de baja densidad de sólidos de alta densidad.
- Requiere la adición de un agente espumante.
- Se utiliza a escala industrial, principalmente en la minería.
- Puede ser un proceso continuo o por lotes.
- La eficiencia depende de factores como el tamaño de partícula, la densidad de los materiales y la elección del agente espumante.


11. Sublimación
Definición general:
Método de separación que aprovecha la transición directa de una sustancia de estado sólido a estado gaseoso (sin pasar por el estado líquido). Se utiliza para purificar sólidos.
¿Qué separa?:
Sólidos que subliman de otros sólidos que no subliman o de impurezas líquidas.
Principio Básico:
Se basa en la diferencia de presión de vapor entre el sólido que sublima y las otras sustancias presentes. Al calentar la mezcla, el sólido que sublima pasa directamente a la fase gaseosa. Luego, el vapor se enfría y se solidifica nuevamente, dejando atrás las impurezas.
Características:
- Útil solo para sustancias que subliman.
- Requiere control preciso de la temperatura y la presión.
- Proceso relativamente limpio, ya que no involucra líquidos.
- Se utiliza a pequeña y gran escala.
- Muy efectivo para purificar ciertas sustancias.
Explicación:
La sublimación es un proceso de separación que explota la propiedad física de algunas sustancias de pasar directamente del estado sólido al gaseoso. Al controlar cuidadosamente la temperatura y la presión, se puede separar selectivamente el componente que sublima, dejando atrás las impurezas. El vapor del componente sublimable se recoge luego y se condensa de nuevo a sólido, resultando en una sustancia purificada.
Ejemplos:
- Purificación de yodo: El yodo sólido se sublima fácilmente, dejando atrás las impurezas.
- Purificación de naftalina: La naftalina se sublima fácilmente, dejando atrás impurezas.
- Separación de dióxido de carbono (CO2) congelado (hielo seco): El CO2 sólido (hielo seco) sublima directamente a gas a temperatura ambiente.
- Separación de cafeína: Aunque complejo, la sublimación es parte del proceso de purificación para la cafeína.


