ENLACE QUÍMICO
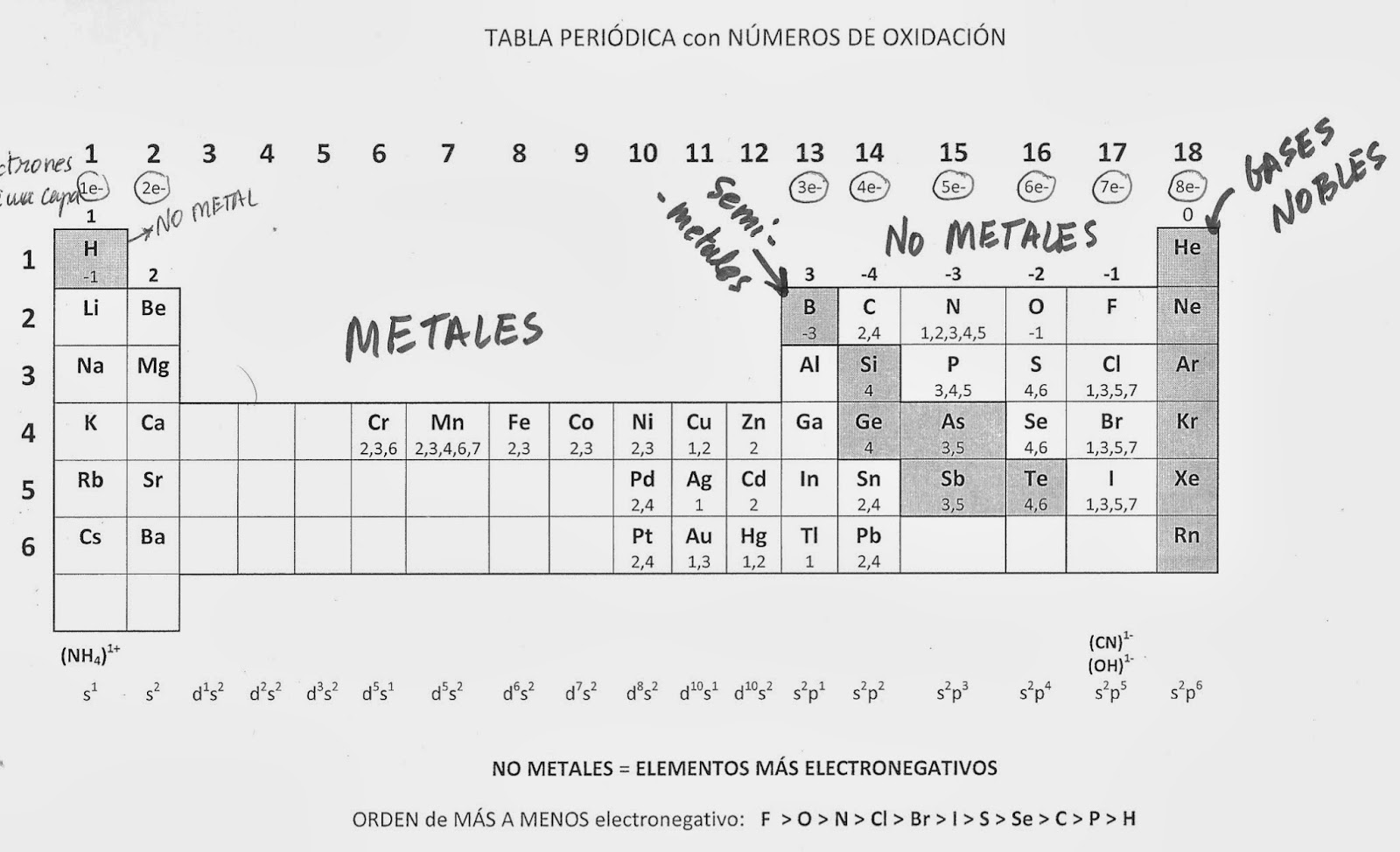
Es la fuerza responsable de la unión entre átomos, iones o moléculas que forman las sustancias.
Regla Del Octeto
En la formación del enlace, los átomos tienden a ceder, ganar o compartir electrones de forma que cada átomo esté rodeado de 8 electrones.
Energía
Cuanto menor es la E del sistema resultante en la formación del enlace, mayor será el enlace de éste.
-Energía de repulsión. Es la energía absorbida por las fuerzas repulsivas entre las nubes electrónicas ( es +)
– Energía de atracción. Disminuye al disminuir la distancia internuclear (es -)
– Energía de enlace. La formación de enlaces va acompañada del desprendimiento de E (es -)
ENLACE IÓNICO
Es la unión entre iones positivos y negativos, el resultado es un compuesto constituido por una red cristalina iónica.
Tiene propiedades tales como la conductividad eléctrica en disolución y solubilidad en agua.
Presentan enlace iónico las sales binarias, los óxidos y los hidróxidos.
Los compuestos iónicos constituyen una red cristalina y cumplen 2 condiciones:
-El empaquetamiento debe ser máximo y deben ocupar el menor volumen
-El cristal debe ser neutro.
Energía de red o Energía reticular es la energía que se desprende en la formación de un mol de ión sólido a partir de sus iones en estado gaseoso.
El calculo de la E reticular es difícil de bbtener experimentalmente y se obtiene por medio del ciclo de Born Haber.
El valor de la energía de red se calcula a partir de las demás energías según la Ley de Hess (el calor es el mismo por el camino 1 que por el camino 2)
ENLACE COVALENTE
Consiste en la unión de dos átomos que comparten uno o más pares de electrones dando lugar al enlace sencillo, doble o triple.
-Enlace Sencillo: (1 par de electrones): F2
-Enlace Doble(2 pares de electrones): C2H4
-Enlace Triple: (3 pares de electrones): N2
*Estructural Resonate: Moléculas que tienen el mismo nº de electrones.
Resonancia
Estructura canónica de resonancia en cada uno de las estructuras que representan una molécula o un ión poliatómico y que digiere de los demás en la ordenación de sus electrones.
Teoría de Enlace de Valencia
Formación de la moléc. de H2. Como cada átomo lleva un orbital 1s’ semiocupados sin interacción entre ellos, estos se van acercando y aparecen las fuerzas de atracción entre el núcleo de 1 átomo y del electrón del otro y laf fuerza de repulsión núcleo-núcleo y electrón-electrón.Cuando la E es mín.los 2 orbitales atómicos se superponen formando el enlace covalente.
En este están los 2 electrones de los H con espines contrarios situados entre los 2 núcleos: Los 2 átomos compiten el par de electrones. El sistema tiene la máxima estabilidad.
Covalencia de un elemento. Es el nº de enlaces covalentes que pueden formar y dependerán del nº de electrones desapareados.
A veces existe la promoción de electrones a un orbital vacío del mismo nivel, con lo cual el nº de enlacesque se van a formar van a ser mayores. Esto explica el enlace sencillo, doble o triple.
En la estructura del NH3 los enlaces N-O no son simples ni dobles sino que son intermedios.
Una mísma moléc. pueden presentar varias estructuras de Lewis cambiando sus estructuras. La estructura real es un híbrido en resonancia en todas ellas.
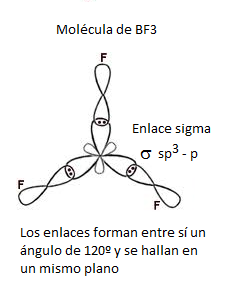
Hibridación de Orbitales Atómicos
El método de hibridación de orbitales justifica la distancia de enlace y la E de enlace de alguna moléculas obtenidos experimentalmente.
Se obtienen orbitales híbridos donde cada elemento reordena sus electrones en los orbitales atómicos dando lugar a los orbitales híbridos que son equivalentes entre sí en forma y energía.
Tipos de Orbitales Híbridos
| ORBITALES | Nº ENLACES | FORMA GEOMÉTRICA | EJEMPLOS |
|---|---|---|---|
| sp | 2 | Lineal | BeCl2 |
| sp2 | 3 | Triagonal plana | BCL3 |
| sp3 | 4 | Tetraédica | CH4 |
Parámetros de enlace
– Energía de enlace o entalpía de enlace es la variación de entalpía cuando se disocia un mol de átomos.
Polaridad
– Moléc. diatómicas u homonucleares. H2F2,N2,O2
Son moléculas apolares debido a que los 2 átomos son iguales y no hay diferencia de electronegatividad entre los átomos.
-Moléculas diatómicas o heteronucleares: Tienen distinta electronegatividad y son dipolar moleculares. Es un enlace polar el elemento más electronegativo atrae hacia él el par de electrones del enlace.
Se dice que el enlace polar es parcialmente iónico debido a que está comprendido entre el enlace apolar y el enlace iónico.
– Moléculas poliatómicas: No van a presentar siempre momentos dipolo.
Fuerzas Intermoleculares
Son fuerzas de atracción entre moléculas de sustancias en estado sólido a líquido covalentes. Hay 2 tipos:
* Fuerzas de Van der Waals:
-Fuerzas dipolo-dipolo. Fuerzas atractivas de dipolos de moléculas polares.
– Fuerzas dipolo-dipolo inducido. Una moléc. polar provoca en una molécula neutra un dipolo inducido.
– Fuerzas de dispersión. Entre moléc. no polarizadas. Existe un desplazamiento de la carga electrónica formandose un dipolo instantáneo.
* Enlace de Hidrógeno:
Es una interacción dipolo-dipolo entre un átomo de H y un átomo de pequeño tamaño y muy electronegativo ( O, F, N ).
Las sustancias con enlace de H tienen punto de fusión y ebulliciójn anormalmente elevado.
Propiedades De Las Sustancias
Sustancias Iónicas
– Constituidos por iones + y – y unidos por enlace iónico.
-Son sólidos de punto de fusión y ebullición altos debido a las elevadas fuerzas de atracción electroestáticas entre los iones.
– Son solubles en agua y en disolventes polares como los alcoholes fenoles. El sólido iónico está rodeado de moléc. de agua y se dice que está soluatado.
-Son conductores en estado fundido o disuelto: cuando se someten a electrosis los iones se desplazan hacia los electrados. El compuesto se llama electrolito.
-No son conductores en estado sólido ya que los iones están fuertemente unidos formando la red cristalina.
ENLACE METÁLICO
Modelo del mar de electrones:
Los átomos se han liberado de sus electrones de valencia y estos forman un mar en el que se insertan los iones metálicos positivos.
Propiedades
– PFy PE elevados, en metales de transición y más bajas en Alcalinos y A. T.
-Alta conductividad eléctrica en estado sólido: Conductores de 1º especie.
– Alta conductividad térmica.
-Prop. mecánica. Ductilidad, maleabilidad y tenacidad de metales aleaciones.
– Densidad elevada debido a sus estructuras compactas ( metales de transición)